服务热线:
18027120927

你是否对医疗器械行业充满兴趣,却苦于“入圈无门”?
这个看似高冷、实则蕴藏巨大机会的行业,其实并不遥远。 今天这篇文章,就带你快速了解:入行医疗器械,你得先搞懂哪些常识? 1.什么是医疗器械? 《医疗器械监督管理条例》第八章,第一百零三条对医疗器械作了如下解释: 第一百零三条 本条例下列用语的含义: 医疗器械,是指直接或者间接用于人体的仪器、设备、器具、 体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件:其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是: (一)疾病的诊断、预防、监护、治疗或者缓解; (二)损伤的诊断、监护、治疗、缓解或者功能补偿; (三)生理结构或者生理过程的检验、替代、调节或者支持: (四)生命的支持或者维持; (五)妊娠控制; (六)通过对来自人体的样本进行检查,为医疗或者诊断目的 提供信息。 简单来说,医疗器械是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品。 其目的不是通过药理学、免疫学或者代谢的方式获得,而是用于疾病的诊断、预防、监护、治疗或者缓解。 一句话概括:不靠吃药打针,用物理、机械等方式解决健康问题的工具,大多都是医疗器械。 2.医疗器械特点
医疗器械需要满足安全和有效的要求。安全就是医疗器械在使用过程中不能对患者的生命和健康造成任何危害,有效是指医疗器械能达到预期诊断、治疗或康复的目的。
安全是医疗器械的基线,是医疗器械从业者不可逾越的底线。
1、法规驱动:全生命周期受严格法规监管,上市需经注册/备案,持续接受质量体系核查。
2、安全至上:首要目标是患者与操作者安全,风险等级越高,管控越严。
3、技术密集:多学科交叉,技术迭代快,产品更新周期短。
4、专业壁垒:需临床验证、专业培训与售后支持,用户粘性高。
5、双轨价值:兼具“治病救人”的社会属性与“高毛利、高投入”的商业属性。
3.医疗器械分类 《医疗器械监督管理条例》第一章,第六条对医疗器械作了如下阐述: 第六条 国家对医疗器械按照风险程度实行分类管理。 第一类是风险程度低,实行常规管理可以保证其安全、有效的 医疗器械。 第二类是具有中度风险,需要严格控制管理以保证其安全、有 效的医疗器械。 第三类是具有较高风险,需要采取特别措施严格控制管理以保 证其安全、有效的医疗器械。 根据风险程度,将医疗器械分为三类: 第一类医疗器械:风险程度低,常见的注射器、外科手术器械等产品浅皮组织使用器械。
第二类医疗器械:具有中度风险,常见的有影像设备、IVD设备等辅助诊断类器械。
第三类医疗器械:具有较高风险,常见的有能量治疗设备、植入器械、手术机器人等侵入人体进行治疗的器械。
4.医疗器械管理制度 对医疗器械,根据不同分类,进行备案和注册管理。 第十三条 第一类医疗器械实行产品备案管理,第二类、第三类医疗器械实行产品注册管理。 医疗器械注册人、备案人应当加强医疗器械全生命周期质量管理,对研制、生产、经营、使用全过程中医疗器械的安全性、有效性依法承担责任。
第一类医疗器械风险程度低,实行常规备案管理,需要在市级药监局备案。
第二类医疗器械具有中度风险,严格管控,实行注册管理,需要在省级药监局注册。
第三类医疗器械具有较高风险,采取特别措施严格管控,实行注册管理,需要在国家药监局注册。
5.医疗器械行业特点
(1) 严格受国家监管
国家针对医疗器械的研制和生产设有相关的监管和法规条例,医疗器械产品必须符合相关国家标准、行业标准和法规要求。
(2) 过程可追溯
医疗器械的研制、生产、经营与使用,要求全生命周期的记录完整可追溯,便于国家监管及发生医疗事故后的问题追溯。
(3) 行业门槛高
医疗器械学科交叉严重,涵盖工程、医学、物理学、生物学、材料、计算机科学、人机交互、美学等学科, 加上严谨的研发流程和体系要求,导致进入医疗器械行业有一定的门槛。
(4) 开发周期长
由于严格的国家监管及过程质量管控,及长周期的测试和临床试验,一款医疗器械经历研制、生产到经营、使用,通常需要3-5年的周期。
做医疗器械研发,产品设计所占的时间大约占60%-70%,剩余30%-40%的时间需要处理设计文档,和体系流程上的工作,这也是医疗器械行业与其他行业最大的不同。
6.医疗器械备案或注册需要哪些资料? 《医疗器械监督管理条例》第二章,第十四条明确了医疗器械注册备案需要的材料,如下所示: 第十四条 第一类医疗器械产品备案和申请第二类、第三类医疗器械产品注册,应当提交下列资料: (一)产品风险分析资料; (二)产品技术要求; (三)产品检验报告; (四)临床评价资料; (五)产品说明书以及标签样稿; (六)与产品研制、生产有关的质量管理体系文件; (七)证明产品安全、有效所需的其他资料。 其中与研发人员强相关的是第(六)点:与产品研制、生产有关的质量管理体系文件。 主要为设计相关的文档,包括产品需求、系统需求、设计规范、设计方案书、设计图纸、Bom清单、物料采购规范及验证报告、装配图、包装说明、测试验证报告等文件,这些文件都需要进行严格的版本管控。 7.什么是无菌医疗器械? 无菌医疗器械是指产品上没有存活的微生物,是医疗器械制造企业以无菌状态提供的医疗器械产品。 通俗来讲,无菌医疗器械,就是一种安全洁净无微生物的器械,医生可以直接拆开使用。无菌医疗器械是由器械本体和包装构成的,包装是保证无菌屏障的关键,二者缺一不可。 8.中国医疗器械细分领域有哪些? 中国医疗器械产业规模比较成熟的细分领域,整体上讲,大概可以分为以下五大方向:医疗设备、高值耗材、体外诊断(IVD)、低值耗材和医用软件系统。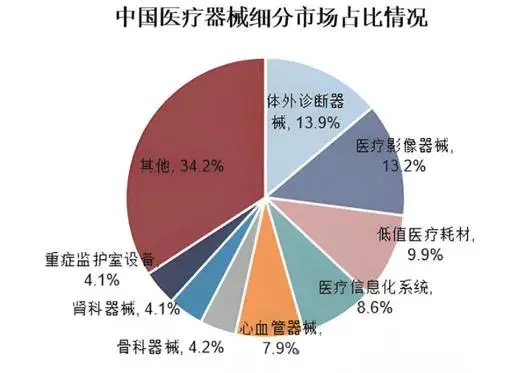
医疗设备:一般为机电设备,由机械零件、电气系统、控制软件构成。
高值耗材:一般需要植入人体,对生物相容性有很高的要求。
体外诊断(IVD):对人体的血液、体液、组织进行检查检验的机电设备,一般由设备和诊断试剂组成。
低值耗材:医院日常经营中经常使用的一次性卫生材料,包括敷料类、注射穿刺类、医用消毒类、麻醉耗材类、手术室耗材类。
医用软件系统:辅助医生进行诊断、治疗和医学数据处理的计算机软硬件技术和网络通信技术。 9.哪些专业可以从事医疗器械行业?
医疗器械属于行业,需要各个专业的人才,并不是只有生物医学工程、或医学专业的同学才能从事,机械设计,材料工程,信号处理,软件工程,电子电气,工业设计等专业均可从事医疗器械行业。
2023年末,教育部发布了引导高校设置医疗装备与工程专业,此专业涵盖物理学,机械设计,信号处理,生物医学工程,医学检验等专业。
10.医疗器械都需要做临床试验吗? 《医疗器械监督管理条例》对临床评价的要求进行了详细说明,如下所示: 第二十四条医疗器械产品注册、备案,应当进行临床评价;但是符合下列情形之一,可以免于进行临床评价: (一)工作机理明确、设计定型,生产工艺成熟,已上市的同品种医疗器械临床应用多年且无严重不良事件记录,不改变常规用途的; (二)其他通过非临床评价能够证明该医疗器械安全、有效的。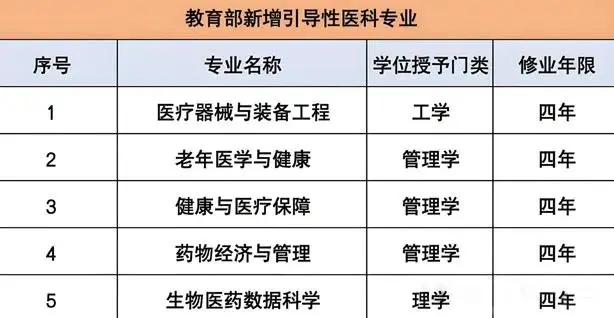
正常情况下医疗器械产品应进行临床试验,对于风险较低和应用较成熟的医疗器械,可以免临床试验,也就是说,并不是所有的医疗器械都需要做临床试验。
对于一类医疗器械这种风险较低的器械,除非存在特殊情况或要求,通常不需要进行临床试验,只需要一些测试验证文件即可;对于二类和三类医疗器械,如果市面上已有类似成熟应用产品,且无医疗事故出现,可以通过与其进行同品种对比免做临床试验。
11.医疗器械注册证去哪里查? 所有的合规(已备案和注册成功)的医疗器械产品,都可以在国家药监局官网查到。 现在,你已经对医疗器械行业有了一个全景式的初步了解。这个行业关乎生命,严谨而复杂,但入门并不难。希望这篇速通指南能为你打开一扇窗,看到更多与健康相关的可能性。